常见问题


来源:河套深港科技创新合作区深圳园区发展署 发布时间:2025.02.12
2020年12月23日,国家药品监督管理局药品审评检查大湾区分中心(以下简称药品大湾区分中心)在河套深圳园区挂牌成立,迄今已走过四周年发展历程。
作为国家药监局直属事业单位,药品大湾区分中心立足河套深圳园区,致力建设粤港澳大湾区药品创新服务平台,为大湾区药品审评检查工作提供强有力支持。目前,该中心已开展沟通指导服务2500余次,服务药品研发主体近2800家次,解答各类咨询问题4100余个;提交各专业审评报告6094份,承接154个药品注册核查任务,开展179次现场检查。
注册地址在粤港澳大湾区(即广东省广州市、深圳市、珠海市、佛山市、惠州市、东莞市、中山市、江门市、肇庆市和香港特别行政区、澳门特别行政区)的申请人可根据不同需求,在该中心官方网站业务工作栏目下载相应表单并发送至对应邮箱,寻求沟通指导帮助,解决药品审评检查相关问题。 
官方网站(www.gbacdei.org.cn)业务工作栏目
01
重点品种服务
对重点品种药品研发及申报阶段遇到的问题提供专人对接指导服务。
邮箱:zdpz@gbacdei.org.cn
工作流程:经《支持和服务大湾区区域药品创新研发重点项目工作方案》推荐但未纳入的项目将被直接纳入重点品种,其他申请品种根据申请情况定期评估反馈。
关于重点项目和重点品种
2023年12月,国家药品监督管理局药品审评中心和药品大湾区分中心联合发布《支持和服务大湾区区域药品创新研发重点项目工作方案》,明确“用于防治严重危及生命或者严重影响生存质量的疾病且尚无有效防治手段或者与现有治疗手段相比有足够证据表明具有明显临床优势的创新药和改良型新药;尚无有效治疗手段的儿童专用创新药和罕见病创新药;应对重大突发公共卫生事件急需的创新药和改良型新药;其他经研究需要纳入重点项目名单的创新药”纳入重点项目名单。
今年6月,作为重点项目政策补充,大湾区分中心发布《药品大湾区分中心服务区域重点品种有关事项的通告》,明确将“经广东省药品监督管理局、深圳市市场监督管理局根据《支持和服务大湾区区域药品创新研发重点项目工作方案》推荐但未纳入的项目;已进入关键性临床研究的新药品种;已进入临床阶段的中药创新药品种;制备工艺确定后的3.1类古代经典名方中药复方制剂;港澳新药品种;属于国家卫生健康委等部门印发的国家短缺药品清单内品种;已列入国家卫生健康委等部门印发的《鼓励仿制药品目录》的品种;粤港澳大湾区国家级重大合作平台(横琴、前海、南沙、河套)管理机构推荐行政区域内的新药品种等”纳入重点品种名单。
02
创新药沟通指导
对申请人在创新药关键研发阶段遇到的问题给予指导。
邮箱:gbacdeisl2@nmpa.gov.cn
回复期限:10-20个工作日
03
立卷指导
对申请人拟提交的1类创新药临床试验申请(IND)资料及港澳申请人拟在内地提交的注册申请资料进行审阅并提供指导。
邮箱:ljzd@gbacdei.org.cn
回复期限:30个工作日内
04
面对面咨询
当面解答申请人关于业务管理、药学审评、医学审评及核查等相关问题。
邮箱:mdmzx@gbacdei.org.cn
咨询时间:每周三9:00-11:30,14:00-16:30(节假日除外);每周一至周三接收下一周的预约申请。
地址:深圳市福田区深港国际科技园G栋9楼906咨询室
05
电话咨询
解答申请人关于受理、项目管理、政策法规等较简单的非技术类问题。
咨询时间:每周二、周四9:00-12:00(节假日除外)
咨询电话:0755-36696226 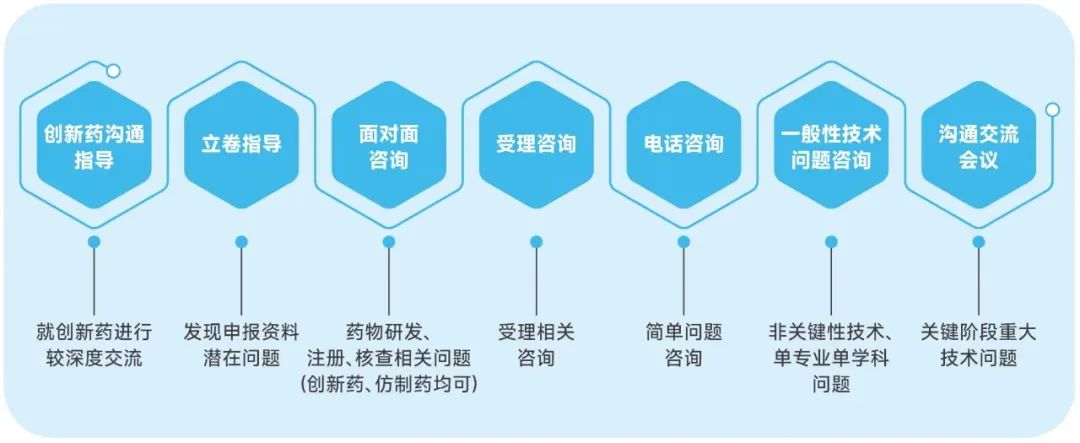
药品大湾区分中心提供的7条沟通渠道